CAR-T细胞治疗近年出现的一种突破性的技术,已在多种癌症治疗中取得显著的效果,给无数晚期癌症患者带来希望。但是目前CAR-T细胞治疗仍存在安全性差和生产成本高两大缺点。
2020年12月6日西北老员工命科学与医学部/桑尼赛尔生物医药肿瘤免疫治疗联合研究中心与陕西省人民医院在第62届美国血液年会上做了题为“A Feasibility and Safety Study of Non-viral Genome Targeting Anti-CD19 CAR-T in Relapsed/Refractory B-Cell Acute Lymphoblastic Leukemia”的poster汇报(Abstract #1017, Session Name: 614. Acute Lymphoblastic Leukemia: Therapy, excluding Transplantation: Poster I. Date: Saturday, December 5, 2020),报道了一种非病毒定点整合CAR-T (nvGT CAR-T)的人体临床研究结果。
nvGT CAR-T采用CRISPR-Cas9基因编辑技术,结合一个非病毒载体,将抗CD19 CAR基因插入到人T细胞的TRAC位点,同时使TCR基因敲除。在理论上,这种方法将会得到更温和的CAR-T细胞。见下图。
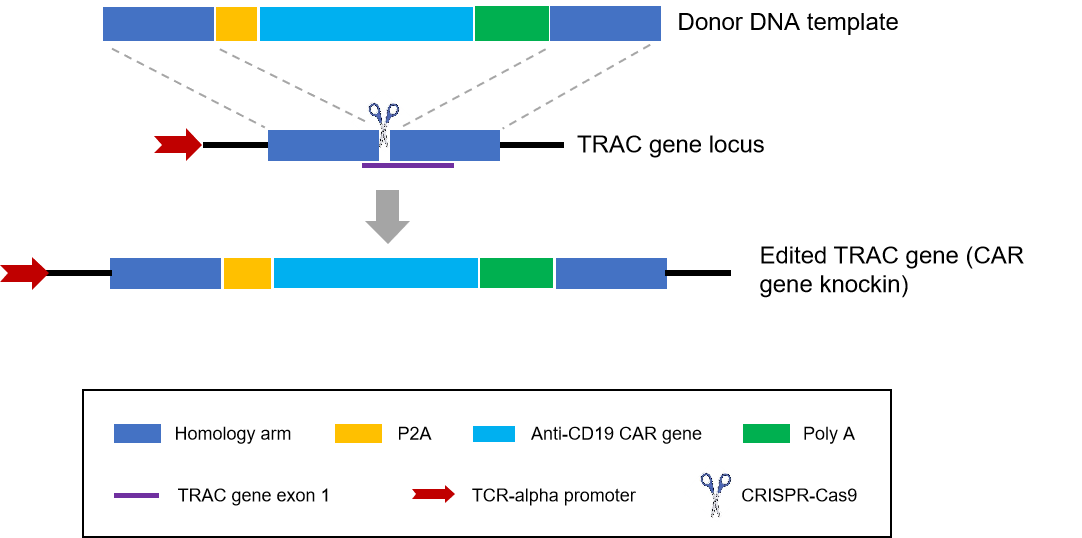
该项研究者发起在r/r B-ALL患者中使用anti-CD9 nvGT CAR-T,评估其安全性与有效性。招募患者21人,现已完成了所有患者的临床治疗和短期的安全性与疗效的评估。基线显示,入组患者为高风险、高负荷、经过多次既往治疗的患者。既往治疗中位数为4次(范围为2-17次),基线的骨髓肿瘤负荷中位数为38.8%(范围为0.3%~99%)。其中,4人移植后复发,15人伴有预后不良基因突变,1人伴有髓外病变。回输剂量中位数为3.8*10^6/kg个CAR阳性细胞。见下图

主要观测到的主要不良反应为细胞因子释放综合征(CRS),神经毒性和感染。20人经历了CRS,多数人为1~2级CRS,仅有4人为三级CRS(19%)。1例二级神经毒性事件(5%)。7人经历感染(33%)。所有患者均未使用妥珠单抗进行干预治疗。CRS发生时间中位数为7天(2~14),持续时间中位数为3天(1~7)。所有患者在治疗后30天均完全恢复。
在治疗后30天,所有患者均达完全缓解(CR),其中19人达最小病灶阴性完全缓解(MRD negative CR)。在14为达治疗后三个月随访的患者中,11人仍未CR状态。3人复发,一位患者为CD19阴性复发,两位患者CD19阳性复发。其中一人再次回输,然而无效。患者SC-7乳腺髓外病变也完全消除。如下图。
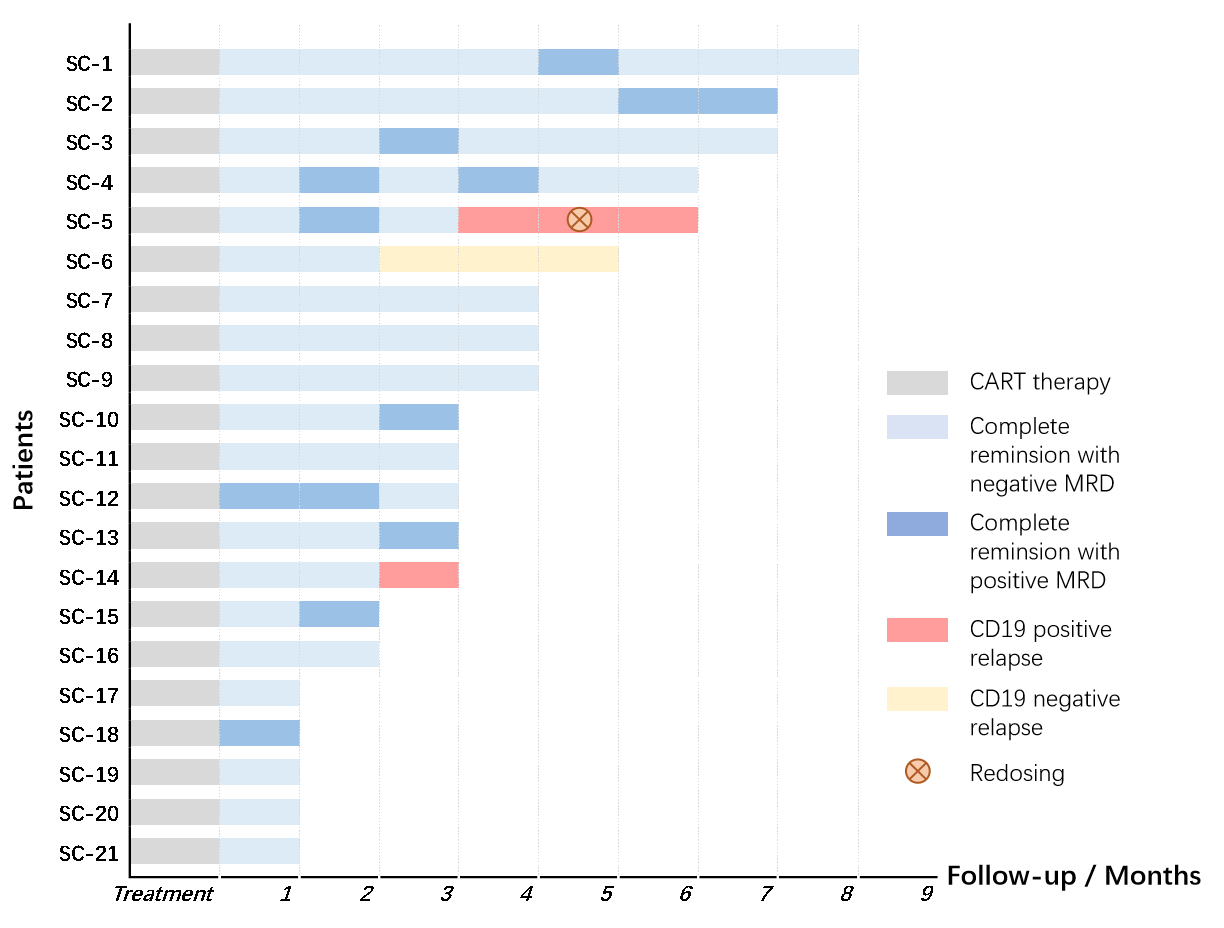
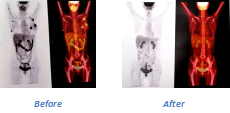
该IIT初步证明了运用基因编辑和非病毒载体制备的CAR-T细胞在敲除TCR基因后,不影响其增殖和短期功能,在通用CAR-T细胞的制备中为避免GvHD而敲除TCR基因,但敲除TCR基因是否会影响通用CAR-T细胞功能尚未有确切证据。该研究或可间接证明短期内敲除了TCR基因对通用CAR-T细胞不会带来影响。
课题主要完成人陕西省人民医院血液内科王一主任表示:“在高肿瘤负荷的患者中,输注较大剂量的CAR-T细胞后,多数患者没有出现严重的CRS,无1例使用IL-6受体拮抗剂,仅有2例短期使用小剂量皮质激素,治疗中无1例患者死亡,所有患者均获得完全缓解。通过我们临床实践发现,与以往病毒来源CAR-T不一样的是,nvGT CAR-T把“谈CAR-T治疗色变”的CAR-T变得更加轻松有效,相信随着nvGT CAR-T在临床上的深入应用,这种新CAR-T技术一定会在CAR-T治疗中大放异彩。”
课题主要完成人西北老员工命科学与医学部/桑尼赛尔生物医药肿瘤免疫治疗联合研究中心主任彭作翰博士表示:“我们很高兴地报告21名受试者接受anti-CD19 nvGT CAR-T的治疗结果,所有患者均完全缓解,中期结果令人满意。另外,通过该试验我们的nvGT CAR-T平台技术展示了卓越的安全性和短期疗效。截至目前,最长随访期的患者已达8个月无白血病生存,我们有信心在未来,能够获得优异的长久疗效数据。nvGT CAR-T是我们多年深耕基因编辑领域结出的第一个硕果,我们将继续推进该技术平台在其他适应症和通用CAR-T中的应用,希望开发出临床急需的细胞治疗药物。”